
La vida comienza con una sola célula fecundada que se transforma gradualmente en un organismo multicelular. Este proceso requiere una coordinación precisa; de lo contrario, el embrión podría desarrollar complicaciones graves. Científicos del Instituto de Ciencia y Tecnología de Austria (ISTA, por sus siglas en inglés) han demostrado que los óvulos de pez cebra, en particular su curvatura, podrían ser el manual de instrucciones que mantiene la división celular según lo previsto y activa los genes adecuados de forma pautada para dirigir la correcta adquisición del destino celular. Estos hallazgos, publicados en Nature Physics, podrían ayudar a mejorar la precisión de las evaluaciones de embriones en la FIV.

Nikhil Mishra abre una pesada puerta que da paso a una habitación única. Innumerables cajas transparentes se almacenan en estanterías repletas de pequeños peces rayados. El agua se refracta a través de los contenedores, proyectando un tono azulado en la habitación. Casi se podría creer estar en medio del mar, y el suave chapoteo del agua y la acogedora temperatura de 27 °C refuerzan esta sensación.
Mishra toma una de las cajas del estante y señala un pez cebra.
“Los peces cebra son un organismo ideal para estudiar las primeras etapas del desarrollo”, explicó con pasión. “Sus embriones se fecundan fuera de la madre, lo que significa que podemos recolectarlos y estudiarlos fácilmente, a menudo cientos a la vez. Además, son transparentes por naturaleza, así que podemos observar literalmente cómo sus células se dividen, se mueven y cambian en tiempo real”.

De sólo una, muchas células #
La vida comienza con un solo óvulo fecundado, llamado cigoto, que comienza a dividirse repetidamente. Primero en dos células, luego en cuatro, luego en ocho, y así sucesivamente. Este proceso es muy similar en la mayoría de las especies, incluyendo a los humanos.** «Al principio, estas divisiones ocurren rápidamente y sin que las células asuman funciones especiales. Pero pronto, comienzan a surgir patrones: algunas células se dividen más lentamente, algunas empiezan a activar genes diferentes y otras se mueven a nuevas posiciones»**, afirmó Mishra.

Una brecha en el conocimiento #
En sus primeras etapas, el cigoto depende de la información que le proporciona la madre. Solo después de alcanzar un hito del desarrollo llamado extensión de la blástula media (MBT), el embrión comienza a desarrollarse de forma independiente. En ese momento, el embrión necesita activar los genes adecuados en el momento oportuno en las células correctas. Pero ¿cómo determina cuándo y dónde activar sus genes? Esta es una pregunta fundamental y una importante laguna de conocimiento que Mishra y el grupo de Heisenberg en ISTA están investigando. Sin embargo, no son los únicos que exploran este misterio.
El grupo de Hannezo también en ISTA, igualmente intenta comprender cómo se coordinan la posición y la sincronización del comportamiento celular individual. Estos dos equipos de investigación llevan tiempo colaborando. En particular, Yuting Irene Li, investigadora postdoctoral del grupo Hannezo, ha contribuido enormemente a la investigación de Mishra con su valiosa experiencia en física teórica, modelado matemático y enfoques estadísticos para sistemas biológicos complejos.

Geometría – el manual de instrucciones #
Esta investigación colaborativa puso a prueba una hipótesis ampliamente ignorada: que la geometría del embrión impulsa su desarrollo. Los científicos del ISTA demostraron que el embrión “lee” e interpreta correctamente la geometría del cigoto durante los primeros minutos de su existencia. Al manipular la geometría del embrión en sus primeras etapas, se modificó el desarrollo posterior de las células.

Pensemos en la geometría del cigoto como un manual de instrucciones que el embrión debe leer y seguir a medida que se moldea. Si hay un error en ese manual o el embrión no lo lee correctamente, podría causar problemas graves; imagina tener un intestino donde debería estar la cabeza.
Como una ola de estadio #
Mishra explicó que la geometría desencadena una serie de eventos de gran importancia que provocan que las células se dividan asimétricamente de forma organizada, creando así un gradiente de tamaño celular. Estas diferencias de tamaño crean un gradiente en los periodos del ciclo celular; las células más pequeñas tardan más en completar un ciclo y dividirse en dos.
Dentro del embrión transparente, este gradiente es claramente visible al microscopio. Las células siguen un ciclo repetitivo, casi como un pequeño reloj interno, marcando la diferencia entre la división y el reposo. «Este ciclo repetitivo, conocido como oscilación, varía ligeramente para cada célula en función de su tamaño, determinado por la geometría del óvulo fecundado», explicó Li, experta en oscilaciones. «En consecuencia, estos diversos «relojes» se alinean en un patrón de barrido a lo largo del embrión. Lo que se observa es una onda de fase mitótica, una onda formada por diferentes células que alcanzan el «momento de división» de sus relojes internos, una tras otra».
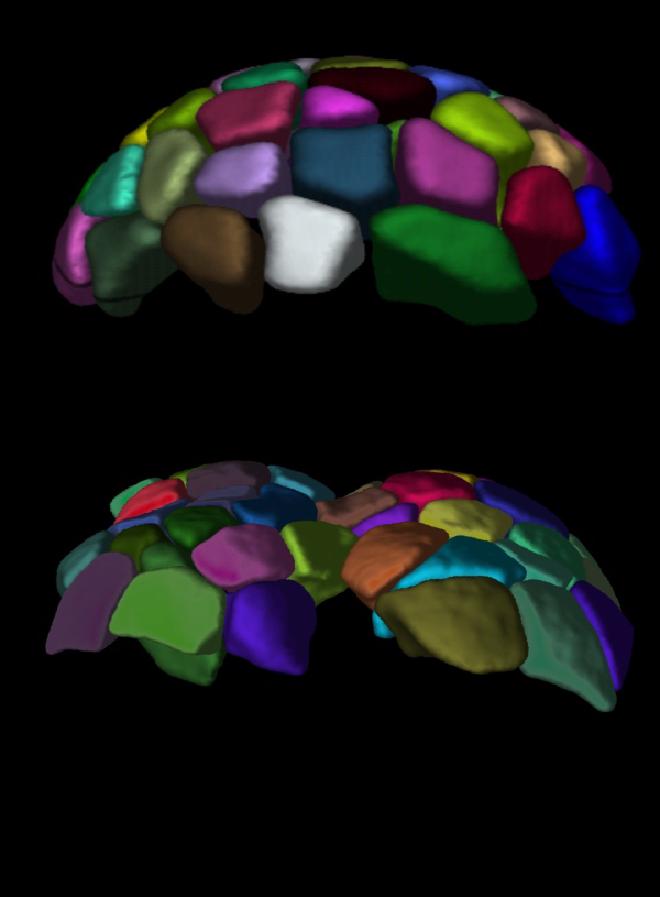
Mejorar los resultados de la FIV #
Para los científicos de la ISTA, el siguiente paso es determinar la universalidad de estos principios. Si se encuentran reglas geométricas similares en mamíferos, y especialmente en humanos, las implicaciones podrían ser muy significativas. Esto cobra relevancia a medida que cada vez más personas recurren a técnicas de reproducción asistida como la FIV. Incluso en personas jóvenes y sanas, menos de la mitad de los embriones de FIV alcanzan la etapa de implantación y dan lugar a embarazos viables.
“Muchos embriones que fallan durante el desarrollo presentan anomalías en los patrones de división temprana o en la forma en que activan sus genes, pero aún no comprendemos completamente por qué. Nuestro trabajo sugiere que la geometría del embrión temprano (la forma física y la disposición de sus primeras células) podría desempeñar un papel importante para mantener el desarrollo en marcha”, concluyó Mishra.
A largo plazo, comprender estos principios podría ayudar a reconocer señales de alerta geométricas tempranas en embriones de FIV y, quizás, diseñar maneras de corregirlas o compensarlas. Esto podría contribuir, a la larga, a una evaluación embrionaria más fiable y a mejores resultados de la FIV.
Citas #
- El estudio Geometry-driven asymmetric cell divisions pattern cell cycles and zygotic genome activation in the zebrafish embryo fue publicado en Nature Physics Autores: Nikhil Mishra, Yuting Irene Li, Edouard Hannezo & Carl-Philipp Heisenberg
Agradecimientos #
Agradecemos -señalaron los investigadores- a N. Petridou (EMBL) por compartir los resultados antes de su publicación. N.M. recibió financiación del programa Horizonte 2020 de la Unión Europea en el marco del acuerdo de subvención Marie Skłodowska-Curie COFUND Actions ISTplus número 754411. Y.I.L. agradece la financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea en el marco del acuerdo de subvención Marie Skłodowska-Curie número 101034413. La investigación recibió financiación de C.-P.H. de la Fundación NOMIS, ID de proyecto 1.844. Nos gustaría agradecer a los miembros pasados y presentes de los grupos Heisenberg y Hannezo por las discusiones, en particular a S. Shamipour, V. Doddihal, M. Jovic, N. Hino, F. N. Arslan, R. Kobylinska y C. Camelo por sus comentarios sobre el borrador del manuscrito. Esta investigación fue apoyada por las Unidades de Servicios Científicos (SSU) del Instituto de Ciencia y Tecnología de Austria a través de recursos proporcionados por las Instalaciones Acuáticas, las Instalaciones de Imágenes y Óptica (IOF), las Instalaciones de Computación Científica (SciComp) y las Instalaciones de Apoyo de Laboratorio (LSF).
Financiación #
El estudio fue financiado por el programa Horizonte 2020 de la Unión Europea bajo las Acciones COFUND ISTplus de Marie Skłodowska-Curie, acuerdo de subvención n.º 754411 (NM); financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea bajo el acuerdo de subvención Marie Skłodowska-Curie n.º 101034413 (YIL) y de la Fundación NOMIS, ID de proyecto 506 1.844 (CPH).
Información sobre estudios en animales: #
Para comprender mejor los procesos fundamentales, por ejemplo, en los campos de la neurociencia, la inmunología o la genética, el uso de animales en la investigación es indispensable. Ningún otro método, como los modelos in silico, puede servir como alternativa. Los animales se crían, mantienen y tratan de acuerdo con normas estrictas.
- El artículo Geometry Shapes Life fue publicado hoy en el sitio web de ISTA, el Instituto de Ciencia y Tecnología de Austria. El texto y las imágenes deben acreditarse a ISTA.
Contacto [Notaspampeanas](mailto: notaspampeanas@gmail.com)

